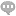在分子生物学实验中,RNA的分离与分析是研究基因表达和调控的重要环节。BPTE电泳缓冲液(1×, RNase free)作为一种为RNA电泳设计的缓冲液,因其高效、稳定且无核酸酶污染的特点,成为实验室中不可或缺的工具。BPTE电泳缓冲液的主要成分包括PIPES、Tris和EDTA,这些成分共同作用,为RNA电泳提供了理想的环境。该缓冲液经过0.1% DEPC处理,确保了无RNase污染,从而保护RNA样品免受降解。其pH值约为6.5,适合RNA在电泳过程中的稳定迁移。优势与特点无核酸酶污染:BPTE缓冲液经过DEPC处理,确保无RNase污染,适合RNA样品的电泳分析。高效分离:该缓冲液能够提供稳定的电泳条件,确保RNA条带清晰、分辨率高。即用型设计:BPTE电泳缓冲液(1×, RNase free)为即用型溶液,无需额外配制,直接使用即可。广适用性:适用于多种类型的RNA电泳实验,包括小片段RNA和长片段RNA的分离。使用方法BPTE电泳缓冲液(1×, RNase free)可以直接用于制备琼脂糖凝胶或作为电泳槽的缓冲液。使用时需注意以下几点:确保所有实验器材和试剂均经过RNase-free处理。在电泳结束后,建议使用RNase-free的核酸染料进行染色,以避免RNA降解。

Tris-乙酸电泳缓冲液(50×TAE):分子生物学实验中的经典选择在分子生物学实验中,琼脂糖凝胶电泳是分析DNA片段大小和纯度的关键技术,而Tris-乙酸电泳缓冲液(50×TAE)作为经典的缓冲液之一,因其高效、稳定和经济的特点,广泛应用于DNA电泳实验。产品特点与优势Tris-乙酸电泳缓冲液(50×TAE)的主要成分包括Tris(三羟甲基氨基甲烷)、乙酸和EDTA(乙二胺四乙酸)。这种配方能够在电泳过程中提供稳定的pH环境,确保DNA片段的清晰分离。高效分离:TAE缓冲液具有较低的离子强度,适合分离大分子量的DNA片段。它能够在电泳过程中提供稳定的电流,确保DNA片段的清晰分离。经济实用:50×的高浓度设计使得该缓冲液在使用时可以根据实验需求灵活稀释,减少浪费,降低实验成本。兼容性强:TAE缓冲液适用于多种类型的琼脂糖凝胶电泳,兼容常见的核酸染料(如EB或GoldView),满足不同实验需求。稳定性高:液体形式的TAE缓冲液在保存和使用过程中更加稳定,只需按照说明稀释即可使用,无需额外配制。使用方法使用Tris-乙酸电泳缓冲液(50×TAE)时,需按照以下步骤操作:稀释缓冲液:根据实验需求,取适量的50×TAE缓冲液,加入去离子水稀释至1×工作液。

10×MOPSRNA缓冲液是一种专为RNA电泳设计的缓冲液,通常用于琼脂糖凝胶电泳中。以下是关于10×MOPSRNA缓冲液的一些详细信息:1.主要成分:-MOPS(3-(N-吗啉代)丙磺酸):一种缓冲剂,提供稳定的pH环境,适合RNA电泳。-EDTA:螯合金属离子,防止RNase酶的活性。-其他成分:可能包括一些盐类,如醋酸钠或硼酸,以维持适当的离子强度。2.用途:-用于RNA电泳,包括总RNA、mRNA、小RNA等的分离和分析。-适用于甲醛变性的或非变性的琼脂糖凝胶电泳。3.特点:-温和的pH环境:MOPS缓冲液的pH值通常在7.0左右,适合RNA的稳定和迁移。-减少RNase污染:含有EDTA,有助于减少RNase酶的活性,保护RNA样品。4.使用说明:-稀释:在使用前,通常将10×MOPSRNA缓冲液稀释至1×工作浓度。-制备凝胶:将琼脂糖粉末与1×MOPSRNA缓冲液混合,加热至琼脂糖完全溶解,然后倒入凝胶模具中。-电泳:将RNA样品与适当的上样缓冲液混合后,加入凝胶孔中,接通电源进行电泳。5.保存条件:-通常建议在室温下保存,避免长时间暴露在空气中,防止水分蒸发或污染。-也可以在4℃下保存,延长其稳定性和使用寿命。
Tris-乙酸电泳粉剂(50×TAE):高效、经济的DNA电泳缓冲液在分子生物学实验中,琼脂糖凝胶电泳是分析DNA片段大小和纯度的关键技术之一。Tris-乙酸电泳粉剂(50×TAE)作为一种高效、经济的缓冲液原料,因其出色的性能和便捷性,成为实验室中不可或缺的工具。产品特点与优势Tris-乙酸电泳粉剂(50×TAE)是一种高浓度的缓冲液原料,主要成分包括Tris(三羟甲基氨基甲烷)、乙酸和EDTA(乙二胺四乙酸)。这种配方能够在电泳过程中提供稳定的pH环境,确保DNA片段的清晰分离。高效分离:TAE缓冲液具有较低的离子强度,适合分离大分子量的DNA片段。它能够在电泳过程中提供稳定的电流,确保DNA条带清晰、分辨率高。经济实用:50×的高浓度设计使得该粉剂在使用时可以根据实验需求灵活稀释,减少浪费,降低实验成本。稳定性高:粉剂形式的TAE在干燥条件下非常稳定,不易受环境因素影响,适合长期储存。兼容性强:适用于多种类型的琼脂糖凝胶电泳,兼容常见的核酸染料(如EB或GoldView),满足不同实验需求。使用方法使用Tris-乙酸电泳粉剂(50×TAE)时,需按照以下步骤操作:称量粉剂:根据实验需求,准确称取适量的Tris-乙酸电泳粉剂。DL100 DNA Marker的使用也非常方便。推荐上样量为5-10 μL,适用于1%-3%的琼脂糖凝胶浓度。

MOPS电泳缓冲液(1×, RNase free):RNA电泳的理想选择在分子生物学实验中,RNA电泳是研究基因表达、RNA结构和功能的重要技术。然而,RNA的稳定性较差,容易被RNase降解,因此在RNA电泳中使用无RNase污染的缓冲液至关重要。MOPS电泳缓冲液(1×, RNase free)凭借其稳定的pH值、高分辨率和无RNase污染的特点,成为RNA电泳的理想选择。产品特点无RNase污染:MOPS电泳缓冲液(1×, RNase free)经过特殊处理,确保无RNase污染,能够有效保护RNA样品免受降解。稳定pH值:MOPS缓冲液的pH值接近中性(pH 6.5-7.9),能够维持稳定的电泳环境,避免RNA在电泳过程中发生降解。高分辨率:MOPS缓冲液具有较低的粘度和较高的缓冲能力,能够有效提高电泳分辨率,确保RNA条带清晰。兼容性强:该缓冲液适用于多种检测方法,如银染、考马斯亮蓝染色或Northern blot。使用方法配制缓冲液:将MOPS电泳缓冲液(1×, RNase free)粉末溶解于去离子水中,搅拌至完全溶解。配制好的1×缓冲液pH值约为7.7±0.2。电泳操作:使用1×MOPS缓冲液制备琼脂糖凝胶或聚丙烯酰胺凝胶,将RNA样品加入凝胶孔中进行电泳。染色与观察:电泳结束后,使用合适的染料(如EB或GoldView)对凝胶进行染色,并在紫外透射仪下观察结果。
其中,部分条带(如1,000 bp或5,000 bp)会加亮显示,便于快速定位和半定量分析。毛霉基因组编辑
Fc融合蛋白技术通过将Fc片段(免疫球蛋白G的恒定区)融合到目标蛋白上,可以带来以下提高蛋白稳定性的优势:1.提高溶解度:Fc片段通常具有较高的溶解性,能够减少目标蛋白的聚集,从而提高其在细胞内的溶解度。2.延长半衰期:Fc片段具有较长的体内半衰期,这一特性可以传递给融合蛋白,延长其在体内的循环时间。3.增强稳定性:Fc片段的结构稳定性有助于维持融合蛋白的构象,减少变性和降解。4.免疫效应:Fc片段可以与体内多种免疫相关细胞和因子相互作用,如通过Fcγ受体介导的效应,增强蛋白的免疫原性或免疫调节功能。5.易于纯化:Fc片段可以利用蛋白A或蛋白G亲和层析高效地从培养液中纯化融合蛋白。6.改善药代动力学特性:Fc片段的融合可以改善蛋白的药代动力学特性,例如改变其在体内的分布和清理速率。7.减少免疫原性:Fc片段有时可以掩盖目标蛋白的免疫原性表位,减少其在体内的免疫反应。8.促进ADCC效应:Fc片段可以介导抗体依赖性细胞介导的细胞毒性(ADCC)效应,增强对特定细胞的靶向作用。毛霉基因组编辑
文章来源地址: http://jxhxp.chanpin818.com/swhg/qtswhg/deta_26200688.html
免责声明: 本页面所展现的信息及其他相关推荐信息,均来源于其对应的用户,本网对此不承担任何保证责任。如涉及作品内容、 版权和其他问题,请及时与本网联系,我们将核实后进行删除,本网站对此声明具有最终解释权。



 [VIP第1年] 指数:3
[VIP第1年] 指数:3