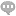如何计算缓冲溶液的有效PH范围电离平衡常数的负对数加减1之间。即pK±1之间。例如以醋酸/醋酸盐为共轭酸碱对的缓冲溶液的有效缓冲范围是:PKa±1=±1之间。即。缓冲溶液是无机化学及分析化学中的重要概念,缓冲溶液是指具有能够维持PH相对稳定性能的溶液。pH值在一定的范围内不因稀释或外加少量的酸或碱而发生***的变化,缓冲溶液依据共轭酸碱对及其物质的量不同而具有不同的pH值和缓冲容量。扩展资料:缓冲液的pH值与该酸的电离平衡常数Ka及盐和酸的浓度有关。弱酸的pKa值衡定,但酸和盐的比例不同时,就会得到不同的pH值。酸和盐浓度相等时,溶液的pH值与PKa值相同。酸和盐浓度等比例增减时,溶液的pH值不变。酸和盐浓度相等时,缓冲液的缓冲效率为比较高,比例相差越大,缓冲效率越低,缓冲液的一般有效缓冲范围为pH=pKa±1,pOH=pKb±1。在络合滴定和分光光度法等许多反应里都要求溶液的pH值保持在一个范围内,以保证指示剂的变色和显色剂的显色等,这些条件都是通过加入一定量的缓冲溶液达到的,所以缓冲溶液是分析测试中经常需要的一种试剂。采用电位滴定法测定外加酸或碱对不同配比同一种缓冲溶液的滴定曲线。 通过选择合适的缓冲液可以确保酶在条件下进行催化反应。HBSS缓冲液有哪些

图中:1固定座、2plc控制器、3筒体、4观察窗、5螺母、6固定螺栓、7进液管、8密封盖、9顶盖、10法兰、11出液斗、12电磁阀、13出液管、14支腿、15移动单元、151万向轮、152安装座、16密封垫圈一、17搅拌单元、171伺服电机、172搅拌轴、173叶片、18固定孔、19密封垫圈二。具体实施方式下面将结合本实用新型实施例中的附图,对本实用新型实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例**是本实用新型一部分实施例,而不是全部的实施例。基于本实用新型中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本实用新型保护的范围。请参阅图1-3,本实用新型提供一种技术方案:一种fbs缓冲液处理装置,包括固定座1、筒体3、顶盖9和出液斗11;固定座1:固定座1底部的四角均设有支腿14,通过支腿14起到支撑的作用,支腿14的底端设有移动单元15,移动单元15包括万向轮151和安装座152,安装座152固定在支腿14的底端,安装座152上对应设有万向轮151,万向轮151上对应设有刹车片,通过万向轮151可以实现装置的移动;筒体3:筒体3设在固定座1的上表面,筒体3上表面的边沿设有法兰10,法兰10的上表面设有密封垫圈二19。海南DPBS缓冲液有哪些在进行pH计校准时,首先需要选择合适的pH缓冲溶液。

法兰10沿圆周方向排列开设有固定孔18,固定孔18位于密封垫圈二19的外侧,通过密封垫圈二19起到密封的作用;顶盖9:顶盖9置于法兰10的上表面,顶盖9上表面边沿的通孔内沿圆周方向排列设有固定螺栓6,固定螺栓6的底端穿过固定孔18延伸至法兰10的下表面,固定螺栓6的底端设有螺母5,顶盖9上表面的一侧设有进液管7,进液管7的底端与筒体3的内腔连通,进液管7的顶端设有密封盖8,通过密封盖8对进液管7进行密封,顶盖9下表面的中部设有搅拌单元17,搅拌单元17包括伺服电机171、搅拌轴172和叶片173,搅拌轴172通过轴承转动连接在顶盖9下表面的中部,叶片173阵列设在搅拌轴172的圆周面,伺服电机171固定在顶盖9的上表面,伺服电机171的输出轴与搅拌轴172的顶端固定连接,伺服电机171的输入端与plc控制器2的输出端电连接,通过伺服电机171的转动,带动搅拌轴172和叶片173的转动,可以对筒体内的液体进行搅拌;出液斗11:出液斗11设在固定座1的底部,出液斗11的顶端与筒体3的内腔连通,出液斗11的底端设有出液管13,出液管13上对应设有电磁阀12,通过出液斗11和出液管13将液体排出,通过电磁阀12控制出液管13的开闭;其中:还包括plc控制器2,plc控制器2设在固定座1的上表面。
分析测试中,在络合滴定和分光光度法等许多反应里都要求溶液的pH值保持在一个范围内,以保证指示剂的变色和显色剂的显色等,这些条件都是通过加入一定量的缓冲溶液达到的,所以缓冲溶液是分析测试中经常需要的一种试剂。 采用电位滴定法测定外加酸或碱对不同配比同一种缓冲溶液的滴定曲线,不仅有助于理解缓溶液及缓冲容量的概念而且对分析测试中正确选缓冲溶液的配制方法及用量具有指导意义。 [3]采用电位滴定法测定缓冲溶液的滴定曲线,选择 了常见的氨水-氯化铵缓冲溶液,分别按照不同的配比得到4种缓冲溶液,实验测定了强酸、强碱对缓冲 溶液的滴定曲线,滴定结果直观清晰,对理解缓冲容 量的概念及实践中缓冲溶液的选择有积极的意义。 [3]为什么缓冲溶液可以维持PH值的稳定呢?

在缓冲溶液中加入少量强酸或强碱,其溶液pH值变化不大,但若加入酸,碱的量多时,缓冲溶液就失去了它的缓冲作用。这说明它的缓冲能力是有一定限度的。缓冲溶液的缓冲能力与组成缓冲溶液的组分浓度有关。0.1mol.L-1HAc和0.1mol.L-1NaAc组成的缓冲溶液,比0.01mol.L-1HAc和0.01mol.L-1NaAc的缓冲溶液缓冲能力大。关于这一点通过计算便可证实。但缓冲溶液组分的浓度不能太大,否则,不能忽视离子间的作用。组成缓冲溶液的两组分的比值不为1∶1时,缓冲作用减小,缓冲能力降低,当c(盐)/c(酸)为1∶1时△pH**小,缓冲能力大。不论对于酸或碱都有较大的缓冲作用。缓冲溶液的pH值可用下式计算:此时缓冲能力大。缓冲组分的比值离1∶1愈远,缓冲能力愈小,甚至不能起缓冲作用。对于任何缓冲体系,存在有效缓冲范围,这个范围大致在pKaφ(或pKbφ)两侧各一个pH单位之内。弱酸及其盐(弱酸及其共轭碱)体系pH=pKaφ±1弱碱及其盐(弱碱及其共轭酸)体系pOH=pKbφ±1例如HAc的pKaφ为4.76,所以用HAc和NaAc适宜于配制pH为3.76~5.76的缓冲溶液,在这个范围内有较大的缓冲作用。配制pH=4.76的缓冲溶液时缓冲能力比较大,此时(c(HAc)/c(NaAc)=1。缓冲液(Buffer solution)通常是由弱酸及其共轭碱或弱碱及其共轭酸缓冲对所组成的溶液。广东EBSS缓冲液采购
配制缓冲溶液作用有哪些?HBSS缓冲液有哪些
假设缓冲溶液里含有弱酸HA以及它的共轭碱。在溶液里发生的质子反应为:水合氢离子的浓度取决于弱酸与其共轭碱的浓度比。当加入少量强碱时,酸被中和,导致了氢氧根离子在溶液中很少累积,从而的浓度增加,的浓度减少。可以看到,虽然加入了强碱,但是溶液里的氢氧根离子变化很少,同时, 浓度较大,相对的变化小,两者比值几乎无变化,因此根据公式,水合氢离子的浓度变化很小。加入弱酸则是同样的道理。由于在 大浓度基数上的微小变化不会改变比值,也因此维持了体系内氢离子和氢氧根离子浓度的平衡。 [1]HBSS缓冲液有哪些
文章来源地址: http://jxhxp.chanpin818.com/swhg/qtswhg/deta_24554930.html
免责声明: 本页面所展现的信息及其他相关推荐信息,均来源于其对应的用户,本网对此不承担任何保证责任。如涉及作品内容、 版权和其他问题,请及时与本网联系,我们将核实后进行删除,本网站对此声明具有最终解释权。



 [VIP第1年] 指数:3
[VIP第1年] 指数:3